由新型冠狀病毒SARS-CoV-2(以下簡稱新冠)引發的COVID-19全球大流行依舊在傳播。本文將從新冠的結構、在研疫苗的技術平臺及優劣勢、最受期待的疫苗所處研發階段、已進入3期臨床研究的疫苗主要研究結果分享等幾個角度出發,為大家做一個快速的干貨梳理概覽。
由新型冠狀病毒SARS-CoV-2(以下簡稱新冠)引發的全球疫情依舊在傳播,并對人類生命健康及經濟發展帶來嚴重的威脅。為保護全人類,開發安全及有效的疫苗成為控制新冠疫情擴散的必要之策。
由于新冠的全基因組序列與SARS-CoV-1相似,并且在人體中結合的受體都是ACE2,從SARS-CoV-1的疫苗開發中獲得對于新冠疫苗開發的啟示顯得尤其重要。通常,疫苗的研發需要經歷約10-15年的周期,而新冠疫苗的研發節奏非常快,一年內,多個科研機構與不同技術平臺的候選疫苗井噴式地出現,包括臨床試驗在內的整個疫苗開發周期也大大縮短,平均僅花費15-18個月。
在國際間科研機構的精誠合作及研發費用投入的共同助力下,截止至2020年12月10日,全球已經有214個候選疫苗分別處于不同的研發階段,其中,有52個疫苗已經進入臨床研究階段,9個疫苗正在進行III期臨床實驗,3個疫苗已經獲得了附條件的上市批復或是緊急使用授權,還有1個正在準備遞交美國緊急使用授權申請。
本文將從新冠的結構、在研疫苗的技術平臺及優劣勢、最受期待的疫苗所處研發階段、已進入3期臨床研究的疫苗主要研究結果分享等幾個角度出發,為大家做一個快速的干貨梳理概覽。
溫馨提示
本文部分內容僅供醫療專業人士閱讀,不能作為您是否接種疫苗的參考。
為節省您的閱讀時間,并盡可能降低閱讀疲勞,我們盡量少寫文字、多用圖。對于每幅圖,我們詳細標注了參考文獻,本文中的所有文獻全部可以在pubmed上免費下載全文。
新冠的結構及在研疫苗的技術平臺
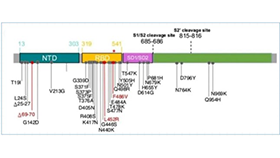
首先,讓我們回顧一下SARS-CoV,MERS-CoV,SARS-CoV-2的基因組織形式及開放基因編碼框(圖1):
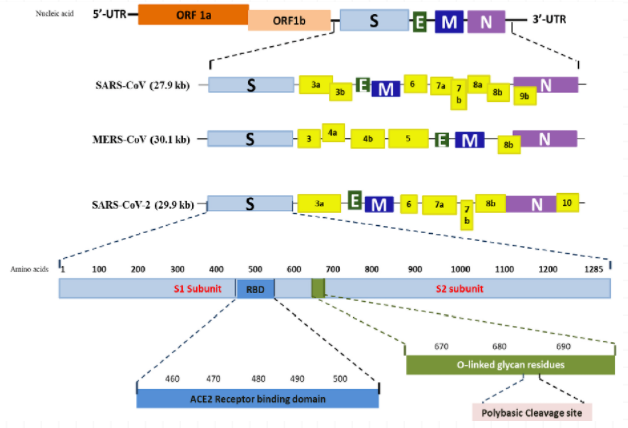
圖1
而后,從SARS-CoV-2病毒的組成入手,就可以直觀地去理解由全球多個科研機構全方位開發的不同技術平臺的疫苗(圖2*):
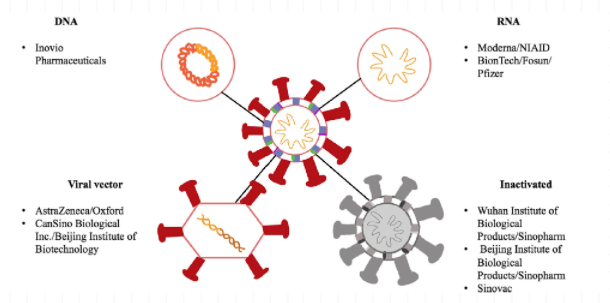
圖2*:來源于文獻圖片,
未全部列出所有在研公司
下面的圖3總結了不同技術平臺的疫苗所針對的靶抗原,從中我們可以發現,在研的絕大多數疫苗的靶點抗原都是新冠病毒的刺突蛋白S:
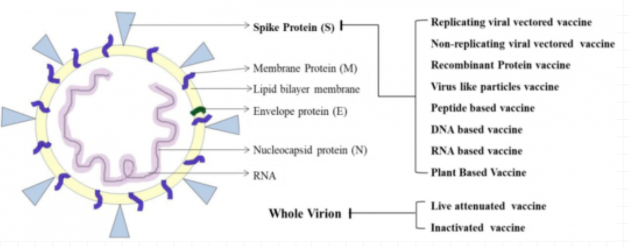
圖3
圖4則展現了全球在研不同疫苗候選平臺的分布:
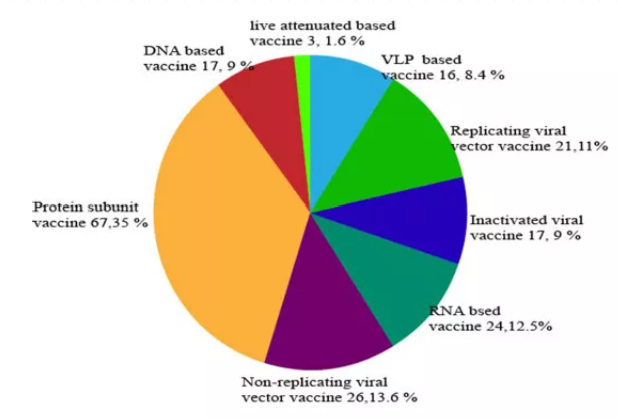
圖4
按照圖中所顯示的占比份額,由多到少進行排序,依次為:蛋白亞單位(35%),非復制的病毒載體疫苗(13.6%),RNA疫苗(12.5%),可復制的病毒載體疫苗(11%),滅活疫苗(9%),NDA疫苗(9%),病毒樣顆粒疫苗(VLP,8.4%),減毒活疫苗(1.6%)。
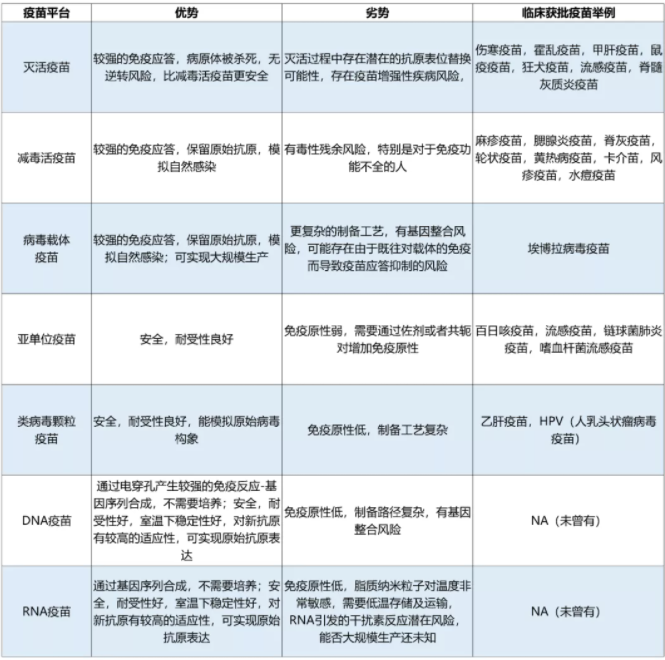
在下表中,我們對不同技術平臺的疫苗進行了優劣勢分析,并同時舉例,方便大家有親切直觀的印象:
表1:不同技術平臺疫苗的優劣勢分析
主要疫苗研究結果分享
目前,由于新冠疫苗研究周期的革命性加速,使得疫苗的有效性及安全性成為大家討論的焦點。在本段落,我們就將對疫苗從研發到生產的流程及周期、以及目前已進入3期臨床研究的疫苗主要研究結果進行討論。
首先,通過圖5與圖6的對比,我們可以看到傳統疫苗與COVID-19疫苗從研發到生產的流程及周期的不同:

圖5:傳統疫苗研發生產流程及周期
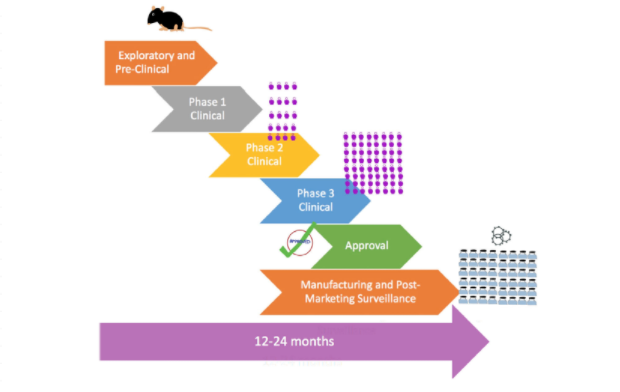
圖6:COVID-19疫苗研發生產流程及周期
接下來,讓我們聚焦目前進入臨床III期的疫苗(表2),并總結一下這些研究的安全性有效性數據(表3-4、圖7-8)。
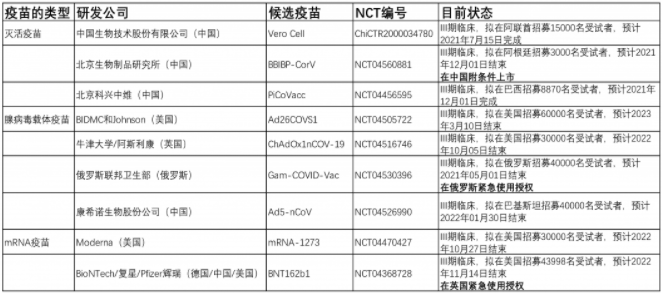
表2:目前進入臨床III期疫苗列表
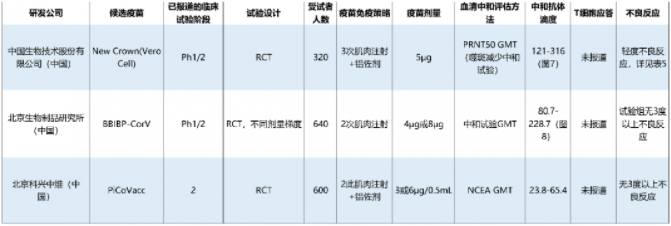
表3:我國進入3期臨床試驗的滅活疫苗已發表的有效性和安全性結果總結
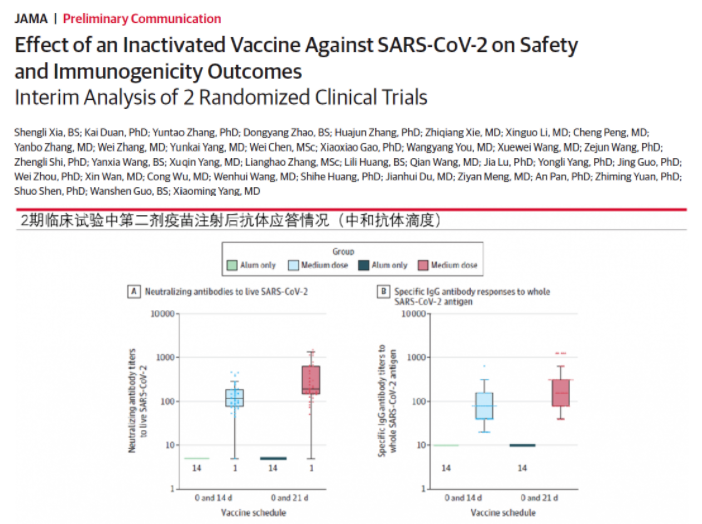
圖7:New Crown 2期臨床試驗中第二次注射疫苗后抗體應答情況
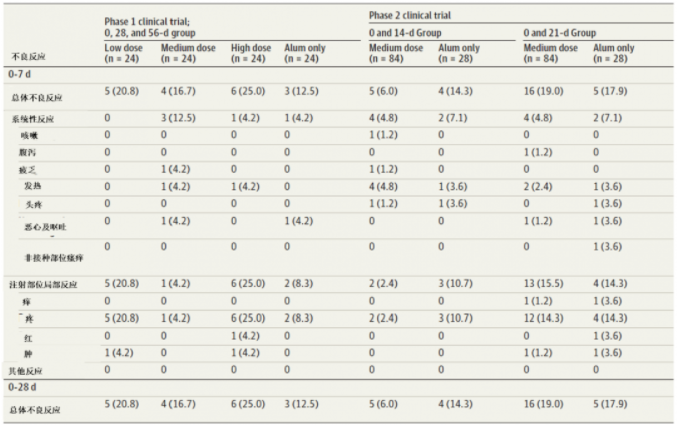
表4:New Crown 2期臨床試驗中第二次注射疫苗后不良反應發生率
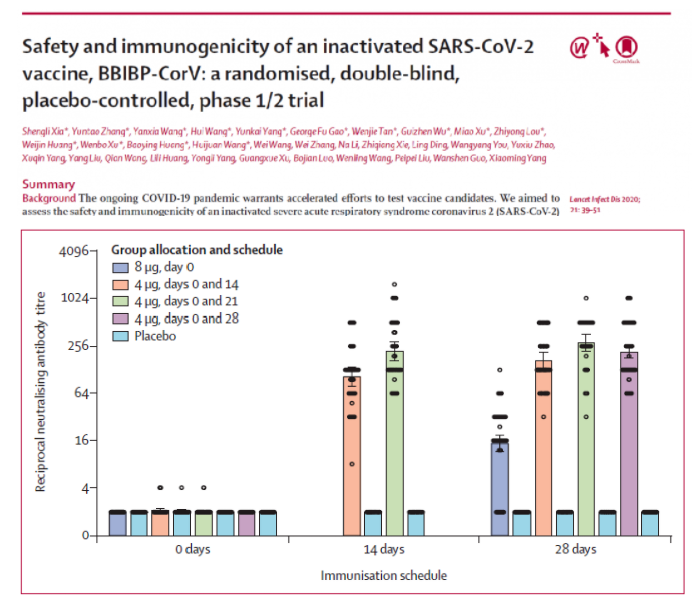
圖8: 北生所BBIBP-CorV疫苗在不同免疫階段的中和抗體滴度
同樣,北生所的疫苗最主要的系統性不良反應是發熱(18–59 years, one [4%] in the 2 μg group, one [4%]in the 4 μg group, and two [8%] in the 8 μg group; ≥60 years, one [4%] in the 8 μg group)。所有不良反應均為輕、中度,且無嚴重的不良事件。
關于國內的三種滅活疫苗,依據發表的關于該疫苗研究的第一篇文獻,伯杰醫療對三款疫苗的序列在數據庫中進行了檢索。其中武生所和科興疫苗研究文獻中公開了相關種子株的序列號。檢索到得北生所得這篇文獻并沒有公開種子株序列。將三家疫苗種子株序列與新冠病毒代表株序列Wuhan-hu-1進行對比,其中科興為S型,北生所和武生所疫苗屬于L型,與Wuhan-hu-1接近。具體信息見下表。
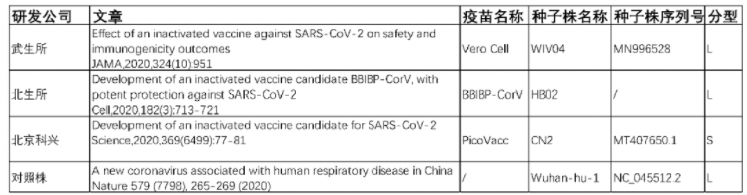
表5
目前,北生所疫苗已經附條件上市,并全民免費接種。截止1月25日,我國已累計開展新冠病毒疫苗接種1500多萬劑次,進一步證明了我國新冠病毒疫苗具備良好的安全性。中國新冠病毒疫苗上市為全球戰勝疫情注入信心,也為疫苗成為全球公共產品提供有力支撐。
參考文獻
[1] Sharma et al. Frontiers in Immunology. 2020, October 2020, 11, 585354.
[2] K. Rawat et al. European Journal of Pharmacology 892 (2021) 173751.
[3] Tafere Mulaw Belete,Infection and Drug Resistance 2021:14 151–161.
[4] Xia S, Duan K, Zhang Y, et al. Effect of an inactivated vaccine against SARS-CoV-2 on safety and immunogenicity outcomes: interim analysis of 2 randomized clinical trials. JAMA. 2020;324 (10):951–960.
[5] Xia S, Zhang Y, Wang Y, et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial. Lancet Infect Dis. 2020;21(1):15.
[6] Hui Wang, Yuntao Zhang, et al. Development of an Inactivated Vaccine Candidate, BBIBP-CorV, with Potent Protection against SARSCoV-2. Cell 2020, 182, 713–721.
[7] Science,2020,369(6499):77-81.
[8] Nature,2020, 579(7798),256-269.
上海伯杰醫療科技有限公司是一家致力于感染性病原體分子診斷試劑研發和應用,深耕于多重熒光PCR診斷試劑和痕量病毒二代測序試劑及相關服務的國家高新技術企業。公司圍繞感染性病原體這一主線,從診斷試劑、診斷儀器、測序服務和醫檢所服務等多個面提供全套解決方案。公司秉承“勇于創新,質量為先”的方針,為醫療機構、疾控公衛、高校科研等合作伙伴提供優質產品與服務。

全國客服電話:400-860-3688















.jpg)